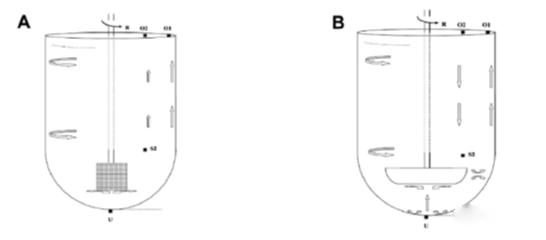
桨法(方法2)和篮法(方法1)见图1,是第一批引入药典的溶出度测试方法,广泛应用在USP专论中。这些USP专论中规定的溶出测试主要是针对药品的质量控制(QC)的,在这些情况下,QC方法也实现了QbD的目标,也可以用于药品的研发中。QC方法用于药品研发的例子包括含BCS I类或III类药物的速释制剂(IR)和调释制剂(MR)的研发 (Grundy and Foster, 1996; Sandberg et al., 1991)。
图1 USP 篮法(A)和桨法(B)
对于其他剂型,把药典推荐方法转换成研发方法的可能性很低。在20世纪90年代出现了生物药剂学分类系统(BCS),认为溶解性和渗透性是影响药物体内性能的关键因素,这对速释制剂(IR)处方的开发具有重要意义。BCS提供了利用桨/篮装置产生的体外数据而不是通过人的体内研究,建立BCS I类药物生物等效性的平台(Amidon et al., 1995; Food and Drug Administration, 2009) 。
1.1剂型
原则上,桨法和篮法可用于所有口服剂型。对于IR药品,一般来说,片剂采用桨法测试时不需要其他额外的硬件,而胶囊通常需要一个沉降装置(Sinker)来保持胶囊处于介质当中或者使用篮法。在研究肠溶包衣(EC)药品的释放特性时,从胃到肠的过程中,使用篮法更容易操作些,例如,在清除或替换介质时。即使肠溶包衣(EC)药品由小丸组成,采用篮法通常也不会有问题。桨法和篮法可用于调释制剂(MR)的测试。由于桨法和篮法中多次改变介质很难,所以在胃肠道内改变制剂性能的制剂难以用桨法或篮法进行跟踪。因此,由于在改变介质组成方面缺乏灵活性,通常用于质量控制(QC)的桨法或篮法,可能没有太大的体内外相关性。
1.2介质
桨法和篮法通常使用500-1000ml的介质体积,这有助于产生溶解药物的漏槽条件,这是一个满足关键质控目标所需要的条件,即表明药物可以完全从制剂中释放出来。然而,这些体积可能与体内的情况没有关系,这取决于该药品是否与食物同服。在胃的早期-中期的消化阶段,体积可能接近1L或更大体积。然而,如果药物是用一杯水在空腹状态下服用的,胃体积不太可能超过250ml,因此溶出试验中所用的体积可能是大了,无法准确反映胃部的状况(Schiller et al., 2005)。对于BCS I类和III类药物,即使在小体积下也可能会满足漏槽条件,溶出介质体积与空腹胃体积的差异不太可能是一个问题。然而,对难溶性药物来讲,溶出中采用大体积可能导致胃的体积被高估了。
就肠道条件而言,体积不是影响漏槽条件是否能够产生的唯一因素。当药物被吸收时,溶液中的药物会由于被肠壁的摄取而减少,也可以产生漏槽条件。因此,是否需要在体外试验中使用漏槽条取决于药物的渗透性和溶解性。对于难溶性药物,在小肠中,与低渗透性药物(BCS IV类)相比,桨法和篮法的体积更适合于BCS II类药物的溶出测试。如果药物的剂量适当,溶出测试可以将小的溶出介质体积和特殊设计的小桨、小溶出杯一起组合来进行。在这种情况下,可以使用的最小体积约为200ml,这特别适用于模拟胃或小肠空腹状态下BCS IV类药物的溶出。Klein等人研究表明,对于桨法,小桨的流体动力学是很恰当的(Klein and Shah, 2008),然而,小桨尚未正式列入任何药典中,其设计和尺寸在各厂家间尚未协调一致。
1.3搅拌
桨法的流体力学模式已进行了详细研究(Baiet al., 2007; Diebold and Dressman, 2001),并建立了几种描述流体力学的计算机模型(McCarthyet al., 2003)。标准USP方法的流体力学是存在问题的,不但因为在这些方法的设计中没有考虑到体内条件,而且因为在溶出杯中流体力学有很大的差异(Bai et al., 2007; Baxter et al., 2005a; D’Arcy et al., 2005)。根据溶出物的大小、形状、密度以及其在溶出杯内落下的位置和/或分布,可以得到不同的溶出结果。很多学者试图建立转速和体内流体力学之间的关系(e.g. Scholz et al., 2002),但结果正如所预期的那样,不一致。例如,Scholz等人在75rpm条件下建立了较粗的和微粉化的felodipine在Labrador犬空腹状态下吸收的相关性(Scholzet al., 2003)。其他研究(Ishii et al., 1996)中,作者为了预测Beagle犬的行为,ibuprofen胶囊的最佳桨速为56rpm。然而,其他研究表明,30rpm的桨度可建立最好的对乙酰氨基酚片的体内外相关性(Rostami-Hodjegan et al., 2002b)。其他通过在USP方法1和2不同转速下的体外溶出度和体内生物利用度数据来建立胃动力模型的研究,在个别情况下都是成功的(Abrahamsson et al., 1998; Shameem et al., 1995)。然而,很显然,将这些研究普遍化是不可能的,因为体外溶出试验的流体力学和胃肠道内的流体力学可能是产品特异性的。因此,虽然可以根据IVIVCs对单个产品来建立预测体内的条件,但是在这种方法中,没有考虑到更多体内相关的体外试验因素。
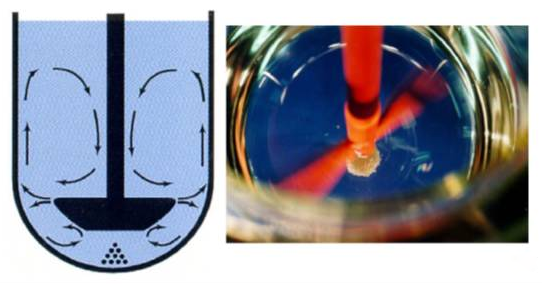
对于最常用的USP方法2,另一个主要问题是可变的流体力学,这是由溶出杯底部出现的堆积效应引起的,见图2(e.g. Qiu et al., 2009)。
图2 USP方法2中杯底的堆积现象
颗粒或具有较高密度的粒子可形成堆形,能够抑制桨下方药物的溶出。类似的情况也可能发生在有大量小粒子通过篮网的篮法中。在溶出方法开发过程中经常遇到这一问题,如果未能充分解决,则有可能在药品开发过程中产生可引起误导的体外数据。例如,在一项关于AstraZeneca公司的不同调释(MR)微丸研究显示,尽管USP方法2中显示出了不同的体外溶出特征,但人体生物等效性研究是等效的。堆积对于释放较慢的处方可以看出来,而当使用peak杯(Peak vessel)进行溶出研究时,这两种制剂间没有显示出差异。这个例子说明在体外观察到的堆积不太可能预示在体内也有类似的现象。
堆积在USP关于溶出的章节中也提到过(US Pharmacopoeia, 2011),可以通过把桨速提高到75rpm或100rpm,或者用所谓的peak杯(Peak vessel)代替圆底溶出杯来解决这个问题。这些策略已被Mirza等人研究过。他们的研究表明,peak杯(Peak vessel)中的溶出与USP杯相比较大(Mirza et al., 2013)。计算流体力学的评估表明,在溶出试验中,片最有可能落在的区域的剪切特异质性在peak杯(Peak vessel)中会减低,但据推测,较高的剪切速率可能导致无法区分真实的溶出之间的差异(Baxter et al.,2005b)。在溶出试验中,通过简单地增加桨速可以减少堆积。事实上,正如Wu等人的例子所示,溶出速率通常在转速较高时增加,但如果转速太快,不同速释制剂(IR)处方间的差别就会受到影响(Wu et al., 2004)。在体外研究中,使用有限数量的速释(IR)模型片(Shah et al.,1992)进行测试时,随着桨速从75rpm增加到100 rpm,溶出速率并没有显著增加,得出的结论是,更高转速100 rpm是没有必要的,特别是在质量控制(QC)的情况下。
在使用USP 方法1和2时,需要考虑额外的因素,以尽量减少由于流体力学效应引起的可变性。这些在其他文献中有详细的描述(Gray et al.,2009)。
1.4.在研发中的使用情况
USP方法 1和2是最常用的方法,主要是因为溶出试验已由与QC相关的部门及科学家们使用了几十年,这些方法在许多方面都是可靠和实用的。近年来,在这些方法中与药典缓冲液相比,已越来越多地使用生物相关介质,特别是在桨法中经常将生物相关介质与BCS II类速释制剂(IR)相结合,来预测/阐明食物和处方的影响。几个有代表性的例子包括食物对danazol的影响(Galia et al.,1998)和各种albendazole处方的比较(Galia et al.,1999)。
对于BCS I类或III类药物,当体内生物等效性研究可以被体外溶出研究代替时,USP 方法1和2可用来进行生物等效豁免的测试(European Medical Agency, 2010),
这些用途的基本假设是,在这种高度可溶的药物中,由于在代表胃肠道的不同pH值下进行试验,体内的相关结果将被获得。这已经被证明是一种成功的方法,在许多情况下,生物等效豁免溶出方法能够预测在健康志愿者体内的生物等效性研究结果(Polli, 2008)。它甚至有可能进一步扩大到采用体外溶出方法,结合生物相关介质和临床数据对生物等效性豁免进行评估的研究中。
文章来源:药事纵横